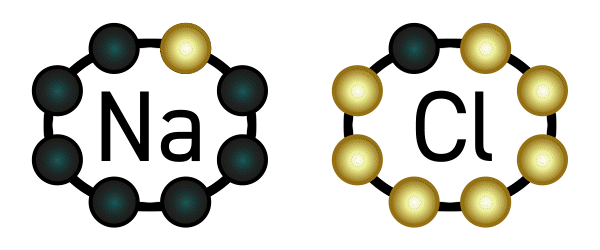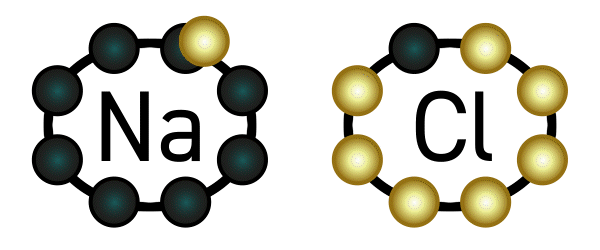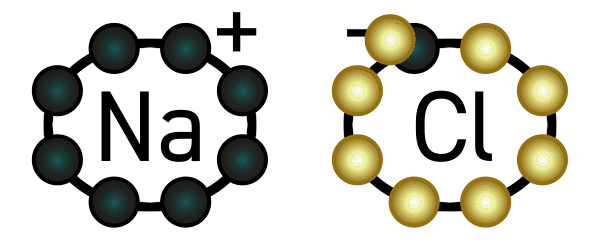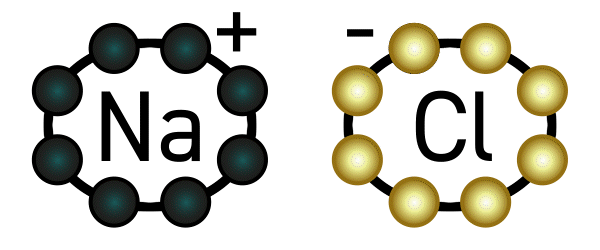Spielanleitung | Ablageplan | App-Support | Datenschutzerklärung | Spektrum | Serien | Elektronenhülle | Easter Eggs
Die Elektronenhülle – eine kurze Erläuterung
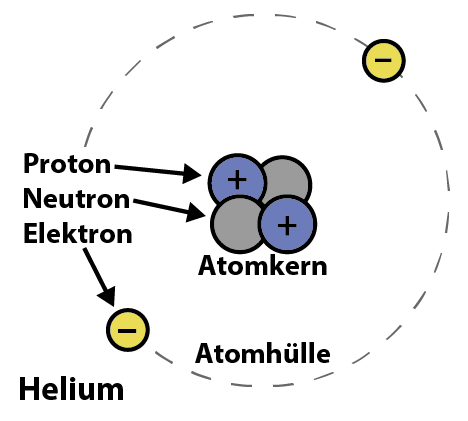
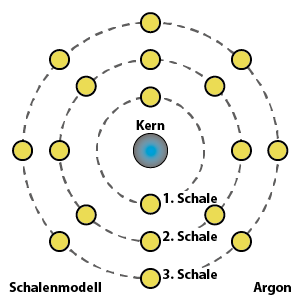
Die Anzahl der Protonen eines Atoms legt fest, zu welchem Element es gehört: Wasserstoff enthät ein Proton, Helium zwei Protonen, Lithium drei usw.. Dies wird auch die Ordnungszahl genannt (im Kartenspiel ist es die kleine Zahl rechts über der Abkürzung in dem Kästchen links oben).
Die Anzahl der Elektronen bestimmt, ob und wie das Atom geladen ist: Sind es gleich viele Elektronen wie Protonen, dann ist das Atom neutral geladen. Sind es mehr Elektronen als Protonen, ist das Atom negativ geladen, und sind es weniger, dann ist es positiv geladen. Geladene Atome werden Ionen genannt.
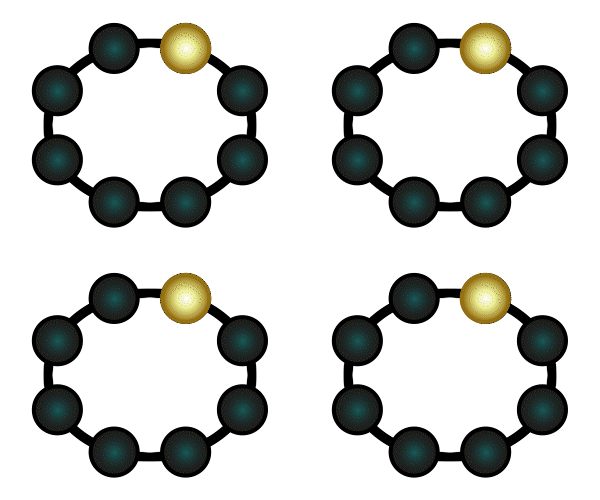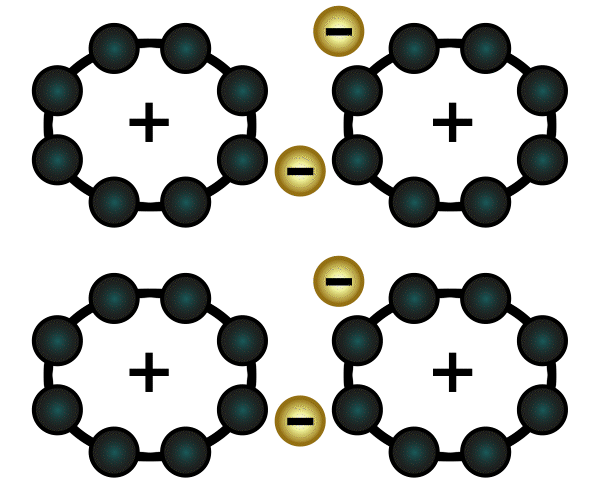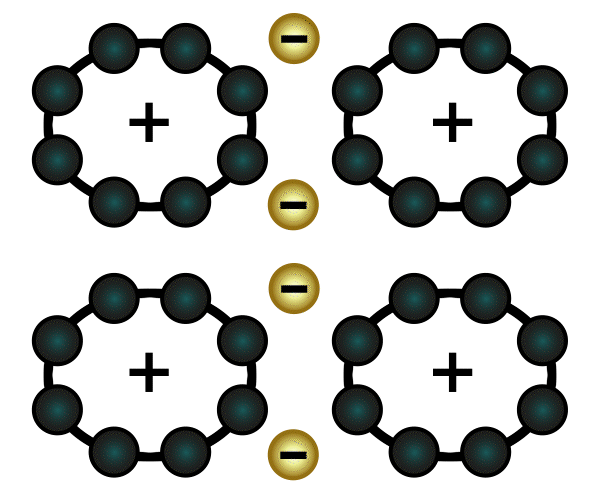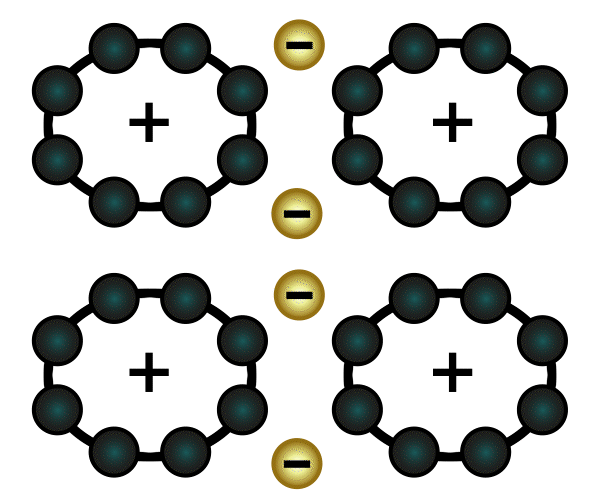
Beispiel: Natrium hat ein Elektron in seiner äußersten Schale und gibt deshalb gerne eines ab. Chlor hat sieben Elektronen in seiner äußersten Schale (es fehlt also nur noch ein Elektron bis zur Acht) und nimmt deshalb gerne ein Elektron auf. Es deutet sich an, dass diese beiden Elemente wunderbar zusammenpassen: Natrium gibt Chlor ein Elektron, und beide sind glücklich.
Nun passiert aber folgendes: Wie wir oben gelesen haben, hat Natrium nun ein Elektron weniger in seiner Hülle und wird dadurch positiv geladen. Chlor wiederum hat ein Elektron mehr, und wird dadurch negativ geladen. Positiv und negativ ziehen sich an: eine Verbindung ist entstanden, genauer gesagt eine Ionenverbindung, weil Natrium und Chlor zu Ionen geworden sind. Diese Verbindung nennt man Natriumchlorid – auch bekannt als Kochsalz.
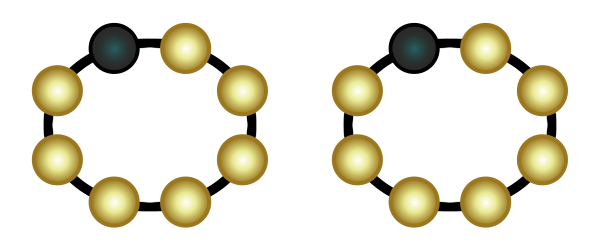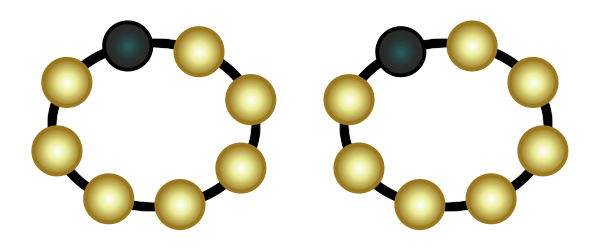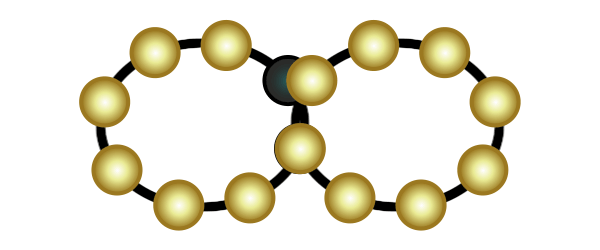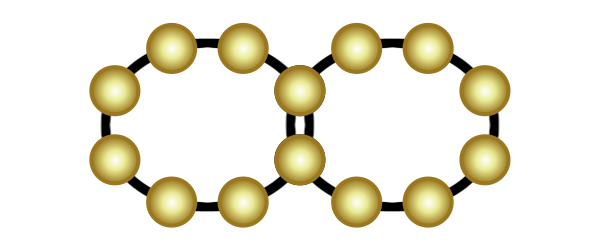
Eine weitere Verbindungsart ist die Molekülverbindung. Wenn zwei Atome jeweils eine Lücke in ihrer äußersten Schale haben, dann können sie so nah an einander rücken, dass ihre Schalen sich überlappen. Sie teilen dann jeweils ein Elektron und schließen somit ihre Lücken (in der Animation rechts wird das veranschaulicht). Das funktioniert auch mit zwei Lücken (Sauerstoff) und mit drei Lücken (Stickstoff).
Bei den Legierungen kommt die sogenannte Metallbindung zum Einsatz. Atome, die nur wenige Elektronen in ihrer äußersten Schale haben, geben diese gerne ab. Wenn mehrere Atome dieser Art zusammenkommen, bilden sie eine Gitterstruktur. Die abgegebenen Elektronen fliegen in diesem Metallgitter zwischen den positiv geladenen Atomen quasi frei umher. Daher spricht man dabei auch vom "Elektronengas". Es sorgt dafür, dass Metalle Strom gut leiten können, denn Strom ist nichts anderes als Elektronen, welche durch das Metall hindurchfließen.
Die Anzahl der Elektronen in der äußersten Schale ist dabei für die Verbindung in Wirklichkeit nicht so wichtig. Grundsätzlich können daher Metalle unterschiedlichster Art miteinander legiert werden. Damit es im Spiel jedoch nicht zu einfach ist, ist das Ablegen von Verbindungen beschränkt auf Paare mit der gleichen Anzahl von Valenzelektronen.